本帖最后由 草船借箭 于 2016-8-8 21:10 编辑 5 u2 D3 W' \4 H) J
4 Z$ D# D' j+ W$ i& t: ~; X
PI3K/Akt/mTOR信号通路和靶向药物: I( I& C J9 L" X1 Y' ^# k
- L9 `& y4 J# u- r
PI3K/Akt/mTOR信号通路和靶向药物
7 w, i) d, R$ Y1 ~PI3K/AKT/mTOR信号通路的梳理着实不易,寄希望该贴梳理的知识帮助到患者和家属。很多癌种都会涉及这个信号通路,很多患者都面对这个信号通路的药物问题。
& s J+ a% @+ h/ t! k经常读报告看到mTOR抑制剂的靶向药物推荐,而且很多基因突变都与该种类型的靶向药物相关,我印象中的基因有PIK3CA,PTEN、NF1等等。当然也不是这些基因随便某个位点出现了改变就可以用mTOR抑制剂,某些变异只是良性多态性,没有影响到蛋白的结构和功能,对于肿瘤的增殖没有影响,相对应的靶向药物推荐也就没有意义。
/ g- X& b' ~! _) }16 P3 |1 Q2 r, ]& a
PI3K信号通路的突变类型) G- b& T9 x9 N2 x1 W
我们不从信号通路的科学去阐释,如此繁多的术语和英文字符看的我自己都头疼,我们先用尽量简单的语言去看PI3K信号通路的突变类型有哪些,该信号通路的激活经常是通过关键节点的直接突变,如PIK3CA和AKT1的激活突变或扩增,以及PTEN这个负调控基因的失活突变。另外PI3K信号通路的激活也可能源于RAS基因,下面的图1是PI3K信号通路的组成部分、和相互之间的抑制和激活关系。/ g" ?5 U( l5 K3 `
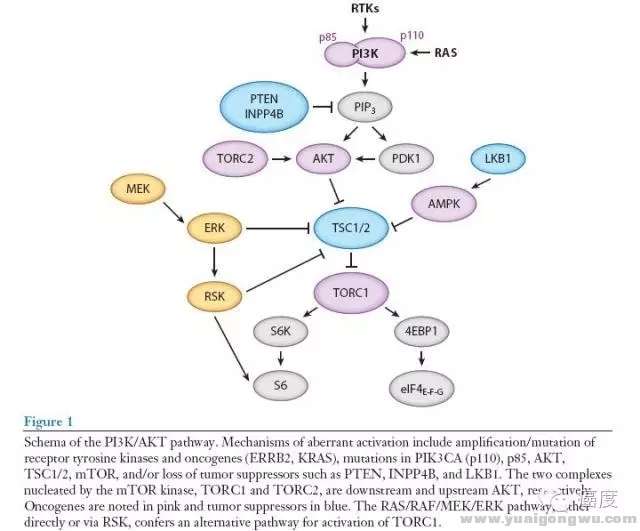
' S, a c, s$ A' G+ A5 t图1:PI3K/AKT信号通路! ^9 ]% d4 ^4 c5 n2 \: l
图1突变的机制包含受体酪氨酸激酶和原癌基因(如ERBB2,KRAS)的基因扩增/突变,PIK3CA、AKT、TSC1/2、mTOR的突变。抑癌基因如PTEN、INPP4B和LKB1的失活突变。mTOR激酶包含两个核蛋白TORC1和TORC2,分别位于AKT基因的上游和下游。粉红色背景框的是原癌基因,而蓝色背景框的是抑癌基因。需要注意的是,MEK和ERK蛋白是涉及到PI3K信号通路中的。所以有时要把两种信号通路的靶向药物联合起来开展临床试验的原因。下面的图2是具体的某些基因的突变形式,以及它们出现的肿瘤类型。
1 h9 \8 ]9 [4 z. r, m
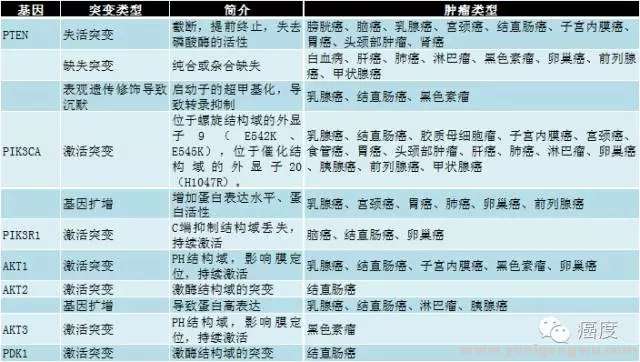
2 _# u9 R/ G% _1 ?7 U( @图2:PI3K信号通路相关的基因突变
& P p5 ]/ G- ^' S* i! U/ j2
; y5 e8 v& U# D7 ?针对mTOR的靶向药物0 J5 T5 R0 m* P2 W: E% A ^
mTOR是一个丝氨酸——苏氨酸激酶,属于PI3K相关的激酶家族,参与介导生长、营养、能量获取等来调控细胞增殖、凋亡等。mTOR处于肿瘤信号通路的关键位置,针对mTOR的抑制剂被广泛应用于肿瘤的靶向治疗。西罗莫司(又称雷帕霉素、雷帕鸣)、依维莫司、替西罗莫司、Ridaforolimus是靶向mTORC1的第一代mTOR抑制剂,它们并称为雷帕霉素及其衍生物,如依维莫司就是雷帕霉素的升级产品。8 n' s. I& L; G3 _; h
雷帕霉素属于大环内酯类抗生素,由于其免疫抑制和其抗增殖的特征,雷帕霉素目前常被单独使用、或与环孢霉素联合用于肾移植手术的免疫排异。目前美国FDA批准了两种用于肿瘤治疗的mTOR抑制剂,替西罗莫司获准用于治疗进展期肾细胞癌。依维莫司获准用于治疗舒尼替尼或索拉菲尼治疗失败的肾细胞癌,依维莫司还获准用于与依西美坦联合治疗激素受体阳性但Her2阴性的乳腺癌、胰腺源性神经内分泌肿瘤、室管膜下巨细胞星形细胞瘤(SEGA)。
5 V$ V( {% D2 d4 p" [9 j O在了解这些药物的临床试验前,我们先来了解下这些药物的使用计量。0 i) z9 h' |( M/ j$ W8 [6 Y
依维莫司的临床试验计量为每天10mg或5mg,21天或28天为一个治疗周期;1 Z0 R' Z" l7 t" D0 o& t. v) w
西罗莫司的临床试验计量为每周20mg或30mg,或每天2mg;/ q; r' d, t9 |5 Y" [9 ^3 S
Ridaforolimus的临床计量为每天12.5mg,28天一个治疗周期,但是1-5和15-19日为服药时间。或者是每星期吃五天,每天40mg;* b# {; W" [, v
替西罗莫司的临床试验计量为每周25mg或15mg,28天一个治疗周期。在神经脑胶质瘤上,计量加大为每周250mg,28天为一个治疗周期;
- A' K5 s* z- S, OmTOR抑制剂的众多临床试验里,有几十个临床试验是单独用药,还有是和其他药物联合,如贝伐单抗、伊马替尼、吉非替尼、环磷酰胺、多西紫杉醇等。联合用药的临床试验结果明显优于单药(具体细节见下图)。mTOR抑制剂的主要副作用是血液毒性、疲劳、口腔炎等,但不管是单药还是联药,副作用是基本上可耐受的。' q# u8 @. a0 ~/ [# T% o
首先看看,mTOR单药在不同临床试验的的临床试验结果。
% w& o6 m4 H9 Z7 H5 g0 Q% j" W' T
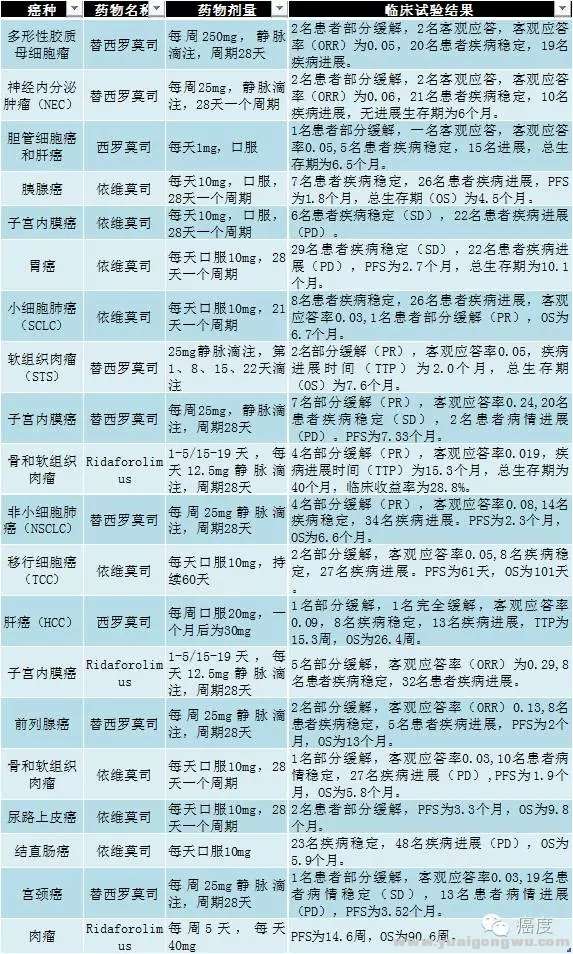
! j( g! y+ A4 q7 H" [* i1 l3 }# b3 v图3:mTOR抑制剂单药的临床试验,总体ORR比例都不高. n4 H1 \9 ]* e x
从上图可知,虽然mTOR抑制剂的单药在不少实体瘤做了不少的临床试验,但是总体客观应答率都不高,大多数客观应答率都低于0.1,最高的ORR是子宫内膜癌,使用Ridaforolimus治疗有0.29的ORR。0 x# c$ ^4 `3 K- x" m1 {' k6 L2 T6 G
如果把mTOR抑制剂和其他靶向药物联合使用,客观应答率会有所改观,看下面这个图来了解下。
* Z1 H/ T& V4 T0 X6 d; K+ [" X

& v# L2 Q+ ?2 D, |% o图4:mTOR抑制剂和其他药物联合临床试验1 {; _* F! Y( |) Y' o: W
图3和图4是对目前mTOR抑制剂单药或者联合用药在多个实体瘤的临床试验总结,mTOR抑制剂单药的有效率非常低,与其他靶向药物和化疗药物联合,抗肿瘤活性获得了一定提高,但仍然缺乏足够的临床活性。因此除去已经批准的适应症外,在使用mTOR抑制剂进行跨适应症治疗时(跨癌种用药),可能需要着重注意有效率这个问题。
( f% Q) u2 {6 E, w9 {35 f) x5 T# ~! Z: \8 z
第二代mTOR抑制剂
' f7 t% n @, l+ F. T4 FmTOR包含两个蛋白复合体,TORC1和TORC2,第一代mTOR抑制剂,如雷帕霉素、依维莫司等,主要的是抑制m-TORC1,这可能会导致对PI3K信号通路的负反馈受到影响,进而增强了AKT的磷酸化活性,m-TORC2的活性增加,这一点已经在临床上被第一代mTOR抑制剂耐药后的重新取样所验证。AKT的活化被认为是这一耐药机制的主要原因。% n5 ]/ o5 V' q1 e0 P
第二代mTOR抑制剂是同时抑制mTORC1和mTORC2,理论上可以通过阻断mTORC2减少AKT的磷酸化。第二代的mTOR抑制剂处在临床试验阶段。比较典型的第二代mTOR抑制剂包含OSI027s、INK128、AZD8055、AZD2014,这些药物正在临床试验中接受评估。某些临床试验结果表明,第二代mTOR抑制剂还是很有前景的,具体的数据我们不再展开累述,有兴趣的读者可以跟踪文献、或临床数据。
5 I0 z$ |! e3 O8 j- l虽然第二代靶向药物没有上市,还在临床阶段,它们也需要面对的一个问题是耐药。不过好在第三代mTOR抑制剂出现了。" { ~6 C; J% X- {: M$ @
4+ Z! T& \- `9 x# c
第三代mTOR抑制剂: Q+ g9 N2 K+ {: D B6 J
不管是一代还是二代mTOR抑制剂都不可避免地存在耐药的问题,有时候耐药的突变最开始就有,即原发性耐药。 a, P& ~2 e0 A% k4 J2 R; I0 p
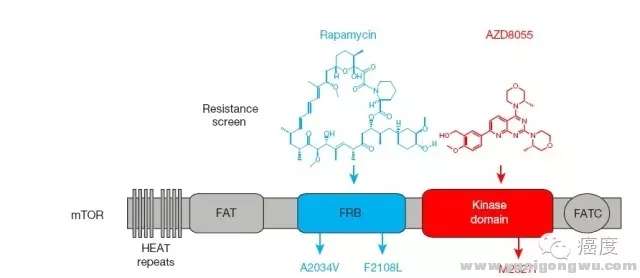
* t: ~# f% g' c: P0 m) _图5:第一代mTOR抑制剂雷帕霉素、第二代mTOR抑制剂AZD8055的耐药位点
9 P; Y& F8 |; q8 g: b也正所谓魔高一尺道高一丈,最近新发表在Nature的论文,报道了第三代mTOR抑制剂。美国加州大学旧金山分校和纪念斯隆-凯特琳癌症中心的研究人员开发的这一药物非常特别,他们把两种药物在分子结构上给连起来,形成一种更加强大的药物。
" A) }; r& d4 O" D9 u5 l" }
8 `- P9 Y$ P( [' u0 e图6:第三代mTOR抑制剂的分子结构,右侧的是雷帕霉素的分子结构,左侧是MLN0128的分子结构8 |8 B6 K6 d9 B; M6 O0 s& M
如上图所示,类似抗体的Y性结构具有两个抗原结合端,它们善于结合到快速发生变化的靶标上。研究者也非常巧妙的将两种作用于不同靶点的mTOR抑制剂雷帕霉素(rapamycin)和MLN0128组合在一起,合成了新的二联体分子RapaLink-1,它可以同时靶向mTOR酶上的两个靶点。即便是存在简单的突变,该药物仍然可以结合和起到抑制作用,不需要完全的匹配。
' A8 ^" \" j) g3 J研究表明,Rapalink能够进入癌细胞内部,关闭mTOR信号,即便是这些癌细胞对早期的抑制剂产生耐药性。研究者也在动物实验中测试了Rapalink抑制肿瘤生长的能力,结果发现它降低对第一代或第二代mTOR抑制剂产生耐药性的肿瘤大小。目前该药已经授权制药公司进行后续研发,希望能尽快相应的临床数据,让患者能尽快获益。9 L7 G1 q/ \1 F1 x+ M# f/ x5 T: g
5
) E8 n3 c& g$ k& G) y8 JPIK3CA导致Her2靶向药物耐药
& u+ E& U% A' b4 W4 }& iPIK3CA位于Her2的下游,因此PIK3CA的激活突变会导致Her2靶向药物耐药,如曲妥珠单抗(赫赛汀)、拉帕替尼联合帕妥珠单抗等等。
2 D5 _. I) w8 n1 n
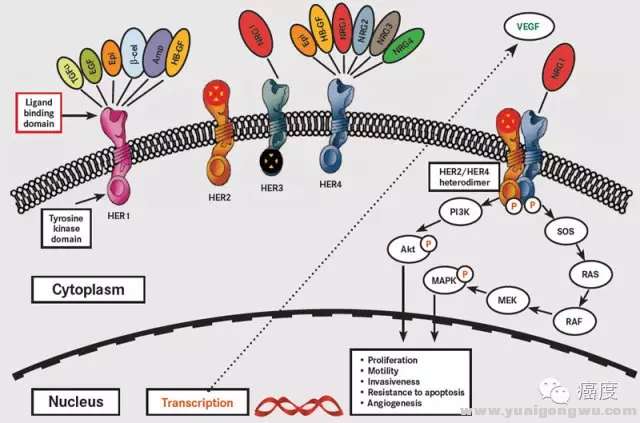
# P. O0 S, p& E/ c1 X3 Q图7:PIK3CA位于Her2蛋白下游,突变导致Her2靶点耐药
9 h; }1 P& K+ k( d3 ^具统计近40%的Her2阳性乳腺癌同时具有PIK3CA的基因突变。老鼠模型试验表明,如果存在Her2基因扩增且同时有PIK3CA的H1047R突变,则更容易发生肺转移。这种耐药可以通过联合PIK3CA的靶向药物去逆转7 c: h& O2 l/ m- B( P+ I
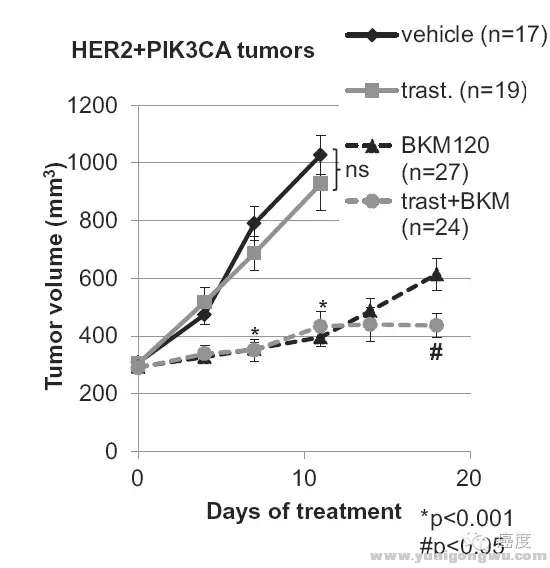
. m, }& b/ e3 N) Y; V/ x图8:PIK3CA突变导致Her2靶向药物抗性,联合BKM120可逆转这一抗性/ `6 V# k0 P5 a8 f) g( O
如图8所示,如果存在PIK3CA突变,使用曲妥珠单抗与安慰剂类似。当然单独使用PIK3CA的靶向药物BKM120优于曲妥珠单抗,原因是PIK3CA在下游,可以起到一定阻碍作用,当然最好的是两者联合,即曲妥珠单抗联合BKM120。这也会使得更大获益。
1 a9 b7 a$ |8 V% Z1 U# EHer2阳性的乳腺癌患者约占总数的20%,因此,在使用Her2靶点,或者使用过一段时间Her2靶点的靶向药物耐药后,可以注意下PIK3CA这个基因的突变情况。' P ?* G& Q0 S5 c ^
& @" o* d4 P( f; k, f( P' m% Q参考文献:6 ?" n' {) S# G5 ~1 k, \/ A
1、Courtney KD et al., J Clin Oncol. 2010 Feb 20;28(6):1075-83.+ K! i T& [+ o( v
2、Zebo Huang et al., Future Oncol. (2015) 11(11), 1687–1699.
2 n& o9 N- {2 u# y% t' n0 Q# q3、Ingrid A et al., Annu. Rev. Med. 2016. 67:11–28./ W% U! r. m, S9 \
4、Powles T, et al.,Eur Urol. 2016 Mar;69(3):450-6.
! z- U* L, q9 I2 _9 s% r! [- g5、Rodrik-Outmezguine VS, et al., Nature. 2016 May 18;534(7606):272-6
* {6 ~) I) F0 L# _4 B5 z6、Ariella B. Hanker,et al., Proc Natl Acad Sci U S A. 2013 Aug 27;110(35):14372-7.
# u0 x1 A9 ^4 M; U7、JEFFREY S. ROSS, et al., The Oncologist 2009;14:320–368. |